Тема уроку: Білки як біологічні полімери. Денатурація білків. Біологічна роль амінокислот і білків.
Уважно перегляньте відеоурок з теми
Опрацюйте план уроку:
1.Коротка історія вивчення білків.
2.Хімічний склад і класифікація білків.
3.Структура білкових молекул.
4.Залежність фізичних властивостей білків від будови.
5.Хімічні властивості білків: гідроліз, денатурація, кольорові реакції.
6.Біологічне значення білків.
Опрацюйте план уроку:
1.Коротка історія вивчення білків.
2.Хімічний склад і класифікація білків.
3.Структура білкових молекул.
4.Залежність фізичних властивостей білків від будови.
5.Хімічні властивості білків: гідроліз, денатурація, кольорові реакції.
6.Біологічне значення білків.
Будова і склад білків.
Молекули білків утворюються у клітині організму з ?-амінокислот (20 амінокислот. Їх ще називають золотими). Вісім із амінокислот (триптофан, лейцин, ізолейцин, лізин, метіонін, фенілаланін, треоніт, валін) належать до незамінних – їх людина одержує з їжею, тому що організмом вони не синтезуються.
Білки- це складні високомолекулярні природні сполуки, побудовані із залишків ?-амінокислот, з’єднаних у певній послідовності пептидним зв’язком.
Білки можна розглядати як поліпептиди (дипептиди, трипептиди, …), тому що їх молекулярна маса більша за 10000.
За хімічним складом білки поділяють на:
– Прості (протеїни) – гідролізуються до амінокислот
– Складні (протеїди) – при гідролізі утворюють крім амінокислот речовини небілкової природи (вуглеводи,фосфатну кислоту, нуклеїнові кислоти)
Білки мають історичні назви. Наприклад, білок складу (С738Н1166О208S2Fe)4 – гемоглобін.
Структура білка (Схема «Структура білків»)
– Первинна;
– Вторинна;
– Третинна;
– Четвертинна.
Первинна – хімічна структура білка, тобто послідовність чергування амінокислотних залишків у поліпептидному ланцюгу даного білка.
Вторинна – форма поліпептидного ланцюга в просторі. Вона може бути ниткоподібною, спіралеподібною та ін. форми.
Третинна – реальна тривимірна конфігурація, утворена складанням вторинних структур (одна глобула).
Третинну структуру можна уявити собі як спіраль, яка згорнута , у свою чергу спіраллю!!!
Четвертинна – поєднання в просторі кількох макромолекул (кілька глобул).
Глобулярні білки – білки, які мають форму клубка.
- Хімічні властивості білків
1) Гідроліз білків
При нагріванні з розчинами кислот чи лугів або під впливом ферментів
Білок + пН2О ? суміш ?-амінокислот
2) Денатурація – руйнування вторинної і третинної структури білка під дією нагрівання, радіації, сильних кислот, лугів, сильного струшування.
Пригадайте приготування яєчні, смаження риби, м яса. Це приклади денатурації.
3) Кольорові реакції на білок:
v Біуретова реакція
Готуємо осад Купрум (ІІ) гідроксид: до розчину Калій гідроксиду додаємо кілька крапель розчину купрум (ІІ) сульфату
КОН + СuSO4 ? Cu(OH)2? + K2SO4
синій осад
До розчину білка додаємо кілька крапель купрум (ІІ) гідроксиду і спостерігаємо характерне фіолетове забарвлення.
v Ксантопротеїнова реакція
Внаслідок дії на білок концентрованої нітратної кислоти виникає жовте забарвлення, яке при додаванні лугу змінюється на оранжеве. Ця реація доводить що білок містить у своєму складі бензольне кільце.
- Біологічна роль амінокислот та білків
- Амінокислоти – це будівельний матеріал для білків.
- Знання властивостей білків допомагає зберегти життя людям: у разі отруєння солями важких металів вживають молоко, білки якого зв’язують ці сполуки.
- Білки їжі не засвоюються організмом, спочатку вони розщеплюються до амінокислот, а потім амінокислоти всмоктуються в кров, а вже з нею переносяться до клітин, де організм синтезує білки.
- Організм людини не здатний синтезувати амінокислоти тому для поповнення їх запасу потрібно вживати білкову їжу.
Можемо зробити висновок, що життя напевно не було б можливим без білків.
ІV. Закріплення вивченого матеріалу
Виконання вправ із друкованого зошита
Білки
Білки (білкові речовини) — макромолекулярні природні сполуки (біополімери), структурну основу яких становлять поліпептидні ланцюги, побудовані із залишків -амінокарбонових кислот. Білки неодмінно містять елементи C, H, N та O, майже завжди S, часто P, рідше Fe, Cu, Zn тощо.
За складом білки поділяють на:
— протеїни — прості білки, що складаються із залишків амінокислот;
— протеїди — складні білки, що складаються із залишків амінокислот та різних небілкових речовин.
Будова білків
У складі білків зустрічаються залишки 20 амінокислот. Властивості білків залежать не тільки від того, які амінокислотні залишки утворюють їх, але і від того, в якій послідовності вони з’єднуються одна з одною. Таку послідовність називають первинною структурою білка:
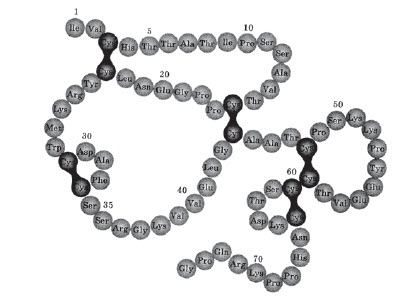
Поліпептидний ланцюг зазвичай згорнутий у спіраль, що має певну просторову структуру —a- спіраль. Спіраль у свою чергу може приймати певну просторову будову, що є власною для кожного білка: спіраль згортається в клубок (глобулу). Таку будову називають третинною структурою білка:
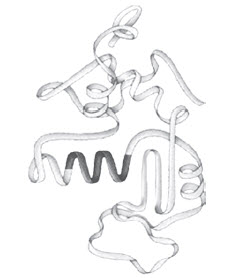
Для деяких білків є характерним об’єднання декількох клубків (субодиниць) в одну частинку, що обумовлює четвертинну структуру білків:
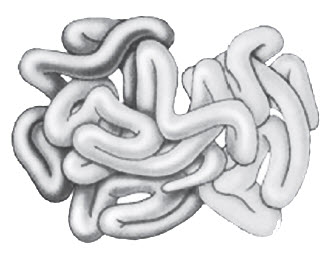
До складу таких об’єднань можуть входити йони металів або інші речовини небілкової природи. Так, молекула білка гемоглобіну складається з чотирьох субодиниць, з’єднаних з йоном Феруму, що дозволяє такій молекулі переносити кисень і вуглекислий газ у тваринному організмі.
Хімічні властивості білків
Унаслідок дії деяких факторів відбувається руйнування тривимірної конформації білка — денатурація, пов’язане зі зміною вторинної, третинної та четвертинної структур; ця зміна може мати тимчасовий або постійний характер, але й у тому, і в іншому випадку амінокислотна послідовність білка (первинна структура) залишається незмінною.
Денатурація білків відбувається під впливом нагрівання або впливом яких-небудь випромінювань, наприклад інфрачервоного або ультрафіолетового. Сильні кислоти, сильні луги й концентровані розчини солей також спричинюють розрив зв’язків (при тривалому впливі й пептидних).
2. Ренатурація.
Іноді денатурований білок за сприятливих умов знову спонтанно набуває своєї нативної (природної) структури. Цей процес називають ренатурацією.
3. Гідроліз.
Найважливішою хімічною властивістю білків є їхня здатність до гідролізу, який може протікати при нагріванні із сильними кислотами або з лугами (кислотно-основний гідроліз) і під дією
ферментів (ферментативний гідроліз). Гідроліз призводить до розпаду поліпептидних зв’язків з утворенням вільних амінокислот.
4. Якісні кольорові реакції білків.
а) біуретова реакція на пептидні зв’язки — дія розведеного розчину купрум (ІІ) сульфату на лужний розчин білка, яка супроводжується появою фіолетово-синього забарвлення розчину, що обумовлено комплексоутворенням між йонами Купруму та поліпептидами;
б) ксантопротеїнова реакція на ароматичні й гетероядерні цикли — дія концентрованої нітратної кислоти з появою жовтого забарвлення; забарвлення пояснюється нітруванням циклів й утворенням нітросполук залишками амінокислот;
в) реакція Міллона — дія на білок реактиву Міллона — розчину Hg(NO3)2 та Hg2(NO3)2 у розведеній HNO3, що містить домішку HNO2,— з появою червоно-коричневого забарвлення, яке обумовлене утворенням пептидних солей Меркурію.
Деякі білки виконують транспортні функції — переносять молекули або йони в місця синтезу або накопичення речовин. Наприклад, в крові міститься білок гемоглобін, що переносить кисень до тканин і вуглекислий газ від них, а білок міо глобін накопичує кисень у м’язах.
Білки — це будівельний матеріал клітин. З них побудовані опорні, м’язові, покривні тканини.
Білки-рецептори сприймають і передають сигнали, що надходять від сусідніх клітин або з навколишнього середовища. Наприклад, дія світла на сітківку ока сприймає білок родопсин.
Білки життєво необхідні будь-якому організму і тому є найважливішою складовою частиною продуктів харчування. У процесі травлення вони гідролізуються до амінокислот, які служать вихідною сировиною для синтезу інших білків, необхідних даному організму. Існують такі амінокислоти, які організм не в змозі синтезувати сам і одержує тільки з їжею,— їх називають незамінними.
Перевірте компетентності


Немає коментарів:
Дописати коментар